RELATIVISMO QUÂNTICO DIMENSIONAL GRACELI.
O POSICIONAMENTO E DISTANCIAMENTO ENTRE PARTÍCULAS, ENERGIAS, E FENÔMENOS ALTERAM TODO SISTEMA FÍSICO DENTRO DAS PARTÍCULAS,,
E QUE TEM AÇÃO DIRETA SOBRE NÚMERO QUÂNTICO, ESTADO QUÂNTICO, ESTRUTURA ELETRÔNICA, NÍVEIS DE ENERGIAS, E ONDAS ESTACIONÁRIAS NAS PARTÍCULAS DENTRO DOS ÁTOMOS,
COM ISTO SE TEM MAIS UM TIPO DE NÚMERO QUÂNTICO, QUE É O NÚMERO QU^NTICO DECA OU MAIS DIMENSÕES DE GRACELI.
SENDO QUE VARIA CONFORME O SDCTIE GRACELI.
COMO TAMBÉM O TEMPO DE FLUXOS, E SPINS, MOMENTUM DOS FENÔMENOS E ENERGIAS,
OU SEJA SENDO VARIÁVEIS CONFORME O SDCTIE GRACELI E FORMANDO O UNIVERSO DIMENSIONAL QUÂNTICO DE GRACELI.
OU SEJA, SE INCLUI NO SISTEMA DE DEZ OU MAIS DIMENSÕES DE GRACELI.
OU SEJA, DIMENSÕES DE ESTADOS QUÂNTICOS DE GRACELI.
E CONFORME O SDCTIE GRACELI.
O SDCTIE GRACELI É ATEMPORAL, OU SEJA PODE SE ENCAIXAR EM QUALQUER PARTE DA FÍSICA, QUÍMICA E OUTROS, E INCLUSIVE ALGUNS ALGUMAS TEORIAS E FUNÇÕES QUE AINDA NÃO FORAM FORMULADAS.
QUANDO SE ADICIONA ALGUM TIPO DE ENERGIA EM UM SISTEMA SE MODIFICA TODO SISTEMA DE TRANSFORMAÇÕES, INTERAÇÕES, DINÂMICAS, POTENCIAIS, ESTADOS QUÂNTICOS, ESTADOS DIMENSIONAIS E FENOMÊNICOS TRANSICIONAIS DE GRACELI, E OUTROS, E CONFORME O SDCTIE GRACELI..
O ESTADO QUÂNTICO DE GRACELI É RELATIVO POR SER VARIÁVEL AO SISTEMA SDCTIE GRACELI, E É INDETERMINADO PORQUE EM CADA ESTRUTURA, ENERGIA, DIMENSÃO DE GRACELI, CATEGORIA GRACELI SE TEM INTENSIDADES E VARIAÇÕES ESPECÍFICAS, MESMO ESTANDO TODO DENTRO DE UM SISTEMA SÓ, CORPO, OU PARTÍCULA.
X
⇔ A FÍSICA DIMENSIONAL GRACELI PODE SER UM BRAÇO DA QUÂNTICA, OU MESMO SER UMA RELATIVIDADE FUNDAMENTADA NUMA TERCEIRA QUANTIZAÇÃO DO SDCTIE GRACELI.
ONDE SE VÊ O MUNDO FÍSICO NÃO APENAS POR QUANTUNS DE MATÉRIA, OU RELAÇÕES DE ONDAS E PARTÍCULAS, MAS NUM MUNDO TRANSCENDENTE E DE INTERAÇÕES E TRANSFORMAÇÕES CONFORME O SDCTIE GRACELI.
OU SEJA, O UNIVERSO DECADIMENSIONAL TRANSCENDENTE DE GRACELI, E NÃO APENAS DE QUANTUNS DE ENERGIAS, OU MESMO DE RELAÇÕES DE ONDAS PARTÍCULAS, OU DE INCERTEZAS.
EM QUE SE FUNDAMENTA EM :
TERCEIRA QUANTIZAÇÃO PELO SDCTIE GRACELI
TRANS-QUÂNTICA SDCTIE GRACELI, TRANSCENDENTE, RELATIVISTA SDCTIE GRACELI, E TRANS-INDETERMINADA.
FUNDAMENTA-SE EM QUE TODA FORMA DE REALIDADE SE ENCONTRA EM TRANSFORMAÇÕES, INTERAÇÕES, TRANSIÇÕES DE ESTADOS [ESTADOS DE GRACELI], ENERGIAS E FENÔMENOS DENTRO DE UM SISTEMA DE DEZ OU MAIS DIMENSÕES DE GRACELI, E CATEGORIAS DE GRACELI.
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS =
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
x
[EQUAÇÃO DE DIRAC].
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE RADIOATIVIDADE
, + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ ENTROPIA REVERSÍVEL
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
ENERGIA DE PLANCK
X
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli +DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
número atômico, estrutura eletrônica, níveis de energia
- TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- DT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLl
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
X
E QUE VARIAM CONFORME O SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
Os números quânticos descrevem valores de quantidades conservadas na dinâmica de um sistema quântico. No caso dos elétrons, os números quânticos podem ser definidos como "os conjuntos de valores numéricos que dão soluções aceitáveis para a equação de onda de Schrödinger para o átomo de hidrogênio",[1] e são de enorme relevância quando se trata de descrever a posição dos elétrons nos átomos.[2]
Introdução[editar | editar código-fonte]
Existem quatro números quânticos:
- número quântico principal;
- número quântico de momento angular ou azimutal (secundário);
- número quântico magnético;
- número quântico de spin.
- SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
Estes quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles dizem o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem. Cada combinação dos quatro números quânticos é única para um elétron.
Os primeiros três números quânticos são usados para descrever orbitais atômicos e a caracterização dos elétrons que neles se encontram. O quarto número quântico, número quântico de spin é utilizado na descrição do comportamento específico de cada elétron. Assim, qualquer par de elétrons pode ter até três números quânticos iguais sendo que, neste caso, necessariamente, o quarto número quântico deverá ser diferente, ou seja, este par de elétrons estará ocupando o mesmo orbital sendo que os elétrons apresentam spins opostos.
Número quântico principal, n[editar | editar código-fonte]
O número quântico principal pode tomar como valor qualquer número inteiro positivo. Como o próprio nome o sugere, este número quântico é o mais importante, pois o seu valor define a energia do átomo de hidrogênio (e de outro átomo monoelectrónico de carga nuclear Z) por meio da equação:
onde m e e são a massa dos nêutrons e a carga do elétron, ε0 é a permissividade do vácuo, e h é a constante de Planck. Esta equação foi obtida como resultado da equação de Schrodinger e é desigual a uma das equações obtidas por Bohr, utilizando os seus postulados correctos.
Número quântico de momento angular, l[editar | editar código-fonte]
O número quântico de momento angular, ou azimutal, informa-nos sobre a forma dos orbitais. Como o próprio nome indica, o valor de l define o momento angular do elétron, sendo que o aumento do seu valor implica o aumento correspondente do valor do momento angular. Deste modo, a energia cinética do elétron é associada ao movimento angular e esta dependente da energia total do elétron, pelo que é natural que os valores permitidos de l estejam associados ao número quântico principal. Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a .
Número quântico magnético, ml[editar | editar código-fonte]
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l.
- l = 0 : corresponde ao subnível s, onde existe somente uma orientação (ml = 0).
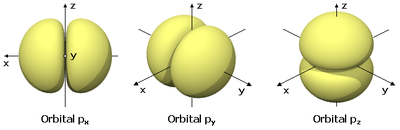
- l = 1 : corresponde ao subnível p, onde existem três orientações permitidas, que surgem em decorrência dos três valores de ml (+1, 0, -1). Os três orbitais p são denominados px, py e pz e são orientados de acordo com os três eixos cartesianoss (x, y e z).
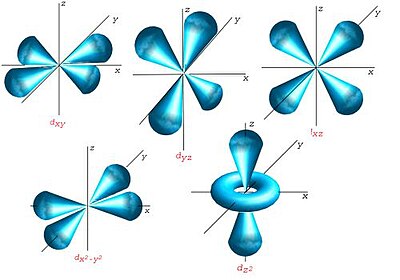
- l = 2 : corresponde ao subnível d onde existem cinco orientações permitidas, ou seja, cinco valores de ml (-2, -1, 0, +1, +2). São designados por dz² (orientação coincidente com o eixo z), dx²-y² (orientação coincidente com os eixos x e y, simultaneamente), dxy (orientado entre os eixos x e y), dyz (orientado entre os eixos y e z) e dxz (orientado entre os eixos x e z).
Número quântico de spin, ms[editar | editar código-fonte]
O número quântico de spin são os autovalores possíveis do operador que indica a orientação da fonte extra de momento angular, sem analogia na mecânica clássica, relativa aos elétrons. Existem apenas dois valores possíveis para este número quântico, -1/2 e +1/2.
A tabela a seguir resume os significados de cada número quântico e os valores que eles podem assumir.
| nome | símbolo | significado do orbital | faixa de valores |
|---|---|---|---|
| número quântico principal | camada | ||
| número quântico azimutal | subnível | ||
| número quântico magnético | deslocamento de energia | ||
| número quântico de spin | spin |
A tabela a seguir mostra a relação entre os números quânticos e os orbitais.
| n | l | Orbital | ml | ms | Número de Combinações |
|---|---|---|---|---|---|
| 1 | 0 | 1s | 0 | -1/2, +1/2 | 2 |
| 2 | 0 | 2s | 0 | -1/2, +1/2 | 2 |
| 2 | 1 | 2p | -1, 0, +1 | -1/2, +1/2 | 6 |
| 3 | 0 | 3s | 0 | -1/2, +1/2 | 2 |
| 3 | 1 | 3p | -1, 0, +1 | -1/2, +1/2 | 6 |
| 3 | 2 | 3d | -2, -1, 0, +1, +2 | -1/2, +1/2 | 10 |
| 4 | 0 | 4s | 0 | -1/2, +1/2 | 2 |
| 4 | 1 | 4p | -1, 0, +1 | -1/2, +1/2 | 6 |
| 4 | 2 | 4d | -2, -1, 0, +1, +2 | -1/2, +1/2 | 10 |
| 4 | 3 | 4f | -3, -2, -1, 0, +1, +2, +3 | -1/2, +1/2 | 14 |
5 -
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
Na química quântica, a estrutura eletrônica é o estado do movimento de elétrons em um campo eletrostático criado por núcleos estacionários.[1] O termo engloba tanto as funções de onda dos elétrons e as energias associadas a elas. Estrutura eletrônica é obtida através da resolução de equações da mecânica quântica para o referido problema de núcleos presos.
Os problemas de estrutura eletrônica surgem da aproximação de Born–Oppenheimer. Junto com as dinâmicas nucleares, o problema da estrutura eletrônica é uma das duas etapas no estudo do movimento de um sistema molecular em mecânica quântica . Exceto por um pequeno número de problemas simples, tais como átomos hidrogenóides, a solução de problemas da estrutura eletrônica requerem computadores modernos.
O problema da estrutura eletrônica é rotineiramente resolvido com programas computacionais para química quântica. Cálculos de estrutura eletrônica encontram-se entre as mais computacionalmente intensivas tarefas de todos os cálculos científicos. Por esta razão, os cálculos de química quântica são ações importantes e tomam muito tempo em supercomputadores científicos.
Um grande número de métodos para obter eletrônico estruturas existentes e sua aplicabilidade varia de caso para caso.[2
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
Na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.[1]
Ernest Rutherford, no início do século XX, realiza o experimento conhecido como espalhamento de Rutherford ,[2] no qual ele incidiu um feixe de partículas alfa (α) sobre uma folha de ouro e observou que, ao contrário do que era esperado - que as partículas deveriam ser refletidas pelos átomos de ouro considerados maciços até então -, muitas partículas atravessaram a folha de ouro e outras sofreram desvios. A partir da análise dessa experiência, afirmou que átomos eram constituídos de uma nuvem difusa de elétrons carregados negativamente que circundavam um núcleo atômico denso, pequeno e carregado positivamente.[1]
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo planetário para o átomo, com elétrons orbitando ao redor do "núcleo-sol". Porém, a aberração mais séria desse modelo é a perda de energia dos elétrons através da radiação síncrotron: uma partícula carregada eletricamente ao ser acelerada emite radiações eletromagnéticas que têm energia; fosse assim, ao orbitar em torno do núcleo atômico, o elétron deveria gradativamente emitir radiações e cada vez mais aproximar-se do núcleo, em uma órbita espiralada, até finalmente chocar-se contra ele. Um cálculo rápido mostra que isso deveria ocorrer quase que instantaneamente.
Postulado de Bohr[editar | editar código-fonte]
Através das descrições quânticas da radiação eletromagnética propostas por Albert Einstein e Max Planck, o físico dinamarquês Niels Bohr desenvolve seu modelo atômico a partir de quatro postulados:[3]
- Os elétrons que circundam o núcleo atômico existem em órbitas que têm níveis de energia quantizados.
- A energia total do elétron (cinética e potencial) não pode apresentar um valor qualquer e sim, valores múltiplos de um quantum.[1]
- Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida (ou suprida) por um simples quantum de luz (também chamado de fóton), que tem energia exatamente igual à diferença de energia entre as órbitas em questão.
- As órbitas permitidas dependem de valores quantizados (bem definidos) de momento angular orbital, L, de acordo com a equação
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
onde n = 1, 2, 3, ... é chamado de número quântico principal e h é a constante de Planck.[4]
A regra 4 afirma que o menor valor possível de n é 1. Isto corresponde ao menor raio atômico possível, de 0,0529 nm, valor também conhecido como raio de Bohr. Nenhum elétron pode aproximar-se mais do núcleo do que essa distância.
O modelo de átomo de Bohr é às vezes chamado de modelo semi-clássico do átomo, porque agrega algumas condições de quantização primitiva a um tratamento de mecânica clássica. Este modelo certamente não é uma descrição mecânica quântica completa do átomo. A regra 2 diz que as leis da mecânica clássica não valem durante um salto quântico, mas não explica que leis devem substituir a mecânica clássica nesta circunstância. A regra 4 diz que o momento angular é quantizado, mas não diz por quê.
Expressão para o raio de Bohr[editar | editar código-fonte]
Considere o caso de um íon com a carga do núcleo sendo Ze e um eléctron movendo-se com velocidade constante v ao longo de um círculo de raio r com centro no núcleo.[5]
A força de Coulomb sobre o electrão é
A força de Coulomb é a força centrípeta. Logo:
Usando a regra de quantização do momento angular de Bohr:
Temos para o n-ésimo raio de Bohr:
E a velocidade do electrão na n-ésima órbita:
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
Equação de Rydberg[editar | editar código-fonte]
A equação de Rydberg, que era conhecida empiricamente antes da equação de Bohr, está agora na teoria de Bohr para descrever as energias de transições entre um nível de energia orbital e outro. A equação de Bohr dá o valor numérico da já conhecida e medida constante de Rydberg, e agora em termos de uma constante fundamental da natureza, inclui-se a carga do elétron e a constante de Planck.[1] Quando o elétron é movido do seu nível de energia original para um superior e, em seguida, recua um nível retornando à posição original, resulta num fóton a ser emitido. Usando a fórmula derivada para os diferentes níveis de energia de hidrogênio, determinam-se os comprimentos de onda da luz que um átomo de hidrogênio pode emitir. A energia de um fóton emitido por um átomo de hidrogênio é determinado pela diferença de dois níveis de energia de hidrogênio:[1]
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
onde ni é o nível inicial , e nf é o nível final de energia. Uma vez que a energia de um fóton está
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
o comprimento de onda do fóton emitido é dada pela
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
Isto é conhecido como a equação de Rydberg, e o R da constante Rydberg é , ou em unidades naturais . Esta equação foi conhecida no século XIX pelos cientistas que estudavam a espectroscopia, mas não havia nenhuma explicação teórica para estas equações ou uma previsão teórica para o valor de R, até Bohr. A propósito, a derivação de Bohr da constante Rydberg, bem como o acordo concomitante da equação de Bohr com as experimentalmente observadas linhas espectrais de Lyman (), Balmer (), e Paschen (), e a previsão teórica bem sucedida de outras linhas ainda não observadas, foi uma das razões para o seu modelo ser imediatamente aceito. Para aplicar em átomos com mais de um elétron, a equação de Rydberg pode ser modificada pela substituição de "Z" por "Z - b" ou "n" por "n - b", em que b é uma constante que representa o efeito de triagem devido a outros elétrons. Isto foi estabelecido empiricamente antes de Bohr apresentar seu modelo.[6]
Níveis energéticos dos elétrons em um átomo de hidrogênio[editar | editar código-fonte]
O modelo do átomo de Bohr explica bem o comportamento do átomo de hidrogênio e do átomo de hélio ionizado, mas é insuficiente para átomos com mais de um elétron.
Segue abaixo um desenvolvimento do modelo de Bohr que demonstra os níveis de energia no hidrogênio.
Sejam as seguintes convenções:
1. Todas as partículas são como ondas e, assim, o comprimento de onda do elétron, , está relacionado à sua velocidade por
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
onde h é a constante de Planck e me, a massa do elétron. Bohr não tinha levantado esta hipótese porque só depois é que foi proposto o conceito associado a esta afirmação (veja dualidade onda-partícula). Porém, permite chegar na próxima afirmação.
2. A circunferência da órbita do elétron deve ser um múltiplo inteiro de seu comprimento de onda:
onde r é o raio da órbita do elétron e n, um número inteiro positivo.
3. O elétron mantém-se em órbita por forças eletrostáticas. Isto é, a força eletrostática é igual à força centrípeta:
onde e qe, a carga elétrica do elétron.
Temos três equações e três incógnitas: v, e r. Depois de manipulações algébricas para obter v em função das outras variáveis, pode-se substituir as soluções na equação da energia total do elétron:
Pelo teorema do virial, a energia total simplifica-se para
Ou, depois de substituídos os valores das constantes:[7]
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
Assim, o menor nível de energia do hidrogênio (n = 1) é cerca de -13.6 eV. O próximo nível de energia (n = 2) é -3.4 eV. O terceiro (n = 3), -1.51 eV, e assim por diante. Note que estas energias são menores que zero, o que significa que o elétron está em um estado de ligação com o próton presente no núcleo. Estados de energia positiva correspondem ao átomo ionizado, no qual o elétron não está mais ligado, mas em um estado desagregado.
O modelo atômico de Bohr pode ser facilmente usado para a composição do modelo atômico de Linus Pauling. Apenas somando as camadas e as colocando na ordem de Pauling.
Frequência[editar | editar código-fonte]
A frequência orbital[5]
(X)
Onde é a velocidade angular orbital do elétron.
A partir da Equação - acima - do movimento orbital mantido pela força de Coulomb acima temos
Substituindo esta expressão na Equação (X) temos:
(Z)
X
SISTEMA DECA [OU MAIS] DIMENSÕES DE GRACELI.
X
SDCTIE GRACELI
Para o átomo - , a qual está na região ultravioleta do espectro electromagnético.
Se o elétron irradia, a energia E irá decrescer tornando-se cada vez negativa e a partir da Equação do raio da órbita r também diminui. O decréscimo em r na Equação (Z), provoca um aumento na frequência f.
De modo que temos um efeito de pista que quando a energia é irradiada, E diminui, o raio orbital r diminui, a qual por sua vez causa um aumento da frequência orbital f e aumentando continuamente a frequência irradiada.
Este modelo planetário prevê que o electrão se mova em espiral para dentro em direção ao núcleo, emitindo um espectro contínuo. Calcula-se que este processo não dure mais do que , um tempo muito curto na verdade.
 [EQUAÇÃO DE DIRAC].
[EQUAÇÃO DE DIRAC].
 + FUNÇÃO DE RADIOATIVIDADE
+ FUNÇÃO DE RADIOATIVIDADE
 + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ FUNÇÃO DE TUNELAMENTO QUÂNTICO. + ENTROPIA REVERSÍVEL
+ ENTROPIA REVERSÍVEL ![\sigma =q(n\mu _{n}+p\mu _{p})[\Omega .cm]^{{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53d1173dd9d9ec55715f1f4beb1ea5dcd4932bc8) FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA ENERGIA DE PLANCK
ENERGIA DE PLANCK